病情描述:
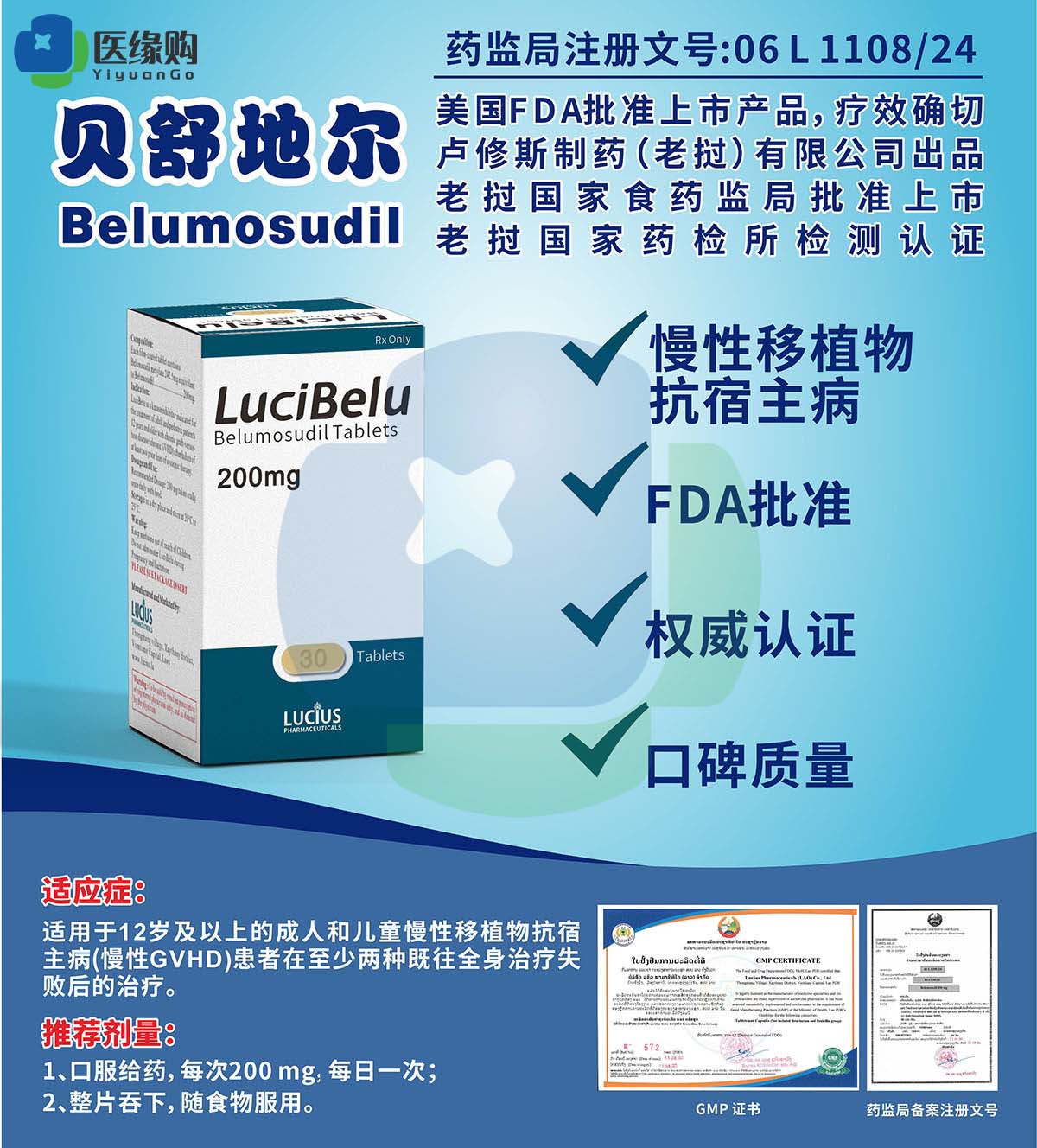
贝舒地尔是什么时候上市的啊?在国内怎么买?

医缘购药师
贝舒地尔(Belumosudil),作为一种新型的靶向治疗药物,近年来在医学界引起了广泛关注。其独特的作用机制和显著的疗效使得它成为治疗慢性移植物抗宿主病(cGVHD)的重要选择。然而,关于贝舒地尔的上市时间,许多患者和医疗工作者可能并不完全了解。本文将详细探讨贝舒地尔的上市时间及其背后的研发历程、临床应用和市场前景,以期为相关人员提供全面的了解和参考。
贝舒地尔(Belumosudil)的上市时间因地区和监管机构的批准进度而异。根据全新的公开信息,贝舒地尔在全球范围内首次获批上市的时间为2021年7月,美国食品与药品监督管理局(FDA)批准其用于治疗既往至少接受过二线治疗后失败的12岁及以上慢性移植物抗宿主病(cGVHD)患者。这一里程碑式的批准标志着贝舒地尔正式进入临床应用阶段,为cGVHD患者提供了新的治疗选择。
随后,贝舒地尔在其他国家和地区也逐渐获得了批准。在国内,贝舒地尔的上市时间稍晚一些,但同样具有重大意义。根据国内国家药品监督管理局(NMPA)的公告,贝舒地尔于2023年8月1日正式获得批准上市,用于治疗对糖皮质激素或其他系统治疗应答不充分的12岁及以上的cGVHD患者。这一批准不仅填补了国内cGVHD二线治疗的空白,也为患者带来了新的希望和可能。
贝舒地尔的研发历程
贝舒地尔的研发历程可以追溯到数年之前,其背后的研发团队经过了长时间的努力和探索,才最终将其推向市场。贝舒地尔是一种Rho相关蛋白激酶2(ROCK2)抑制剂,通过抑制ROCK2信号通路来调节免疫系统的平衡。这一作用机制使得贝舒地尔能够特异性地针对cGVHD的病理生理过程,从而发挥治疗效果。
在研发过程中,贝舒地尔经历了多个阶段的临床试验,包括I期、II期和III期等。这些临床试验的目的是评估贝舒地尔的安全性、有效性和理想剂量等关键参数。通过大量的患者数据分析和长期观察,贝舒地尔展现出了显著的疗效和较低的副作用,为其最终获得批准上市奠定了坚实的基础。
贝舒地尔的临床应用
贝舒地尔的临床应用主要集中在cGVHD的治疗上。cGVHD是一种异基因造血干细胞移植后常见的并发症,患者常常面临着严重的炎症反应和多器官组织纤维化等问题。传统的一线治疗方法包括糖皮质激素和钙调神经磷酸酶抑制剂等,但有效率仅为50%左右。对于二线治疗失败的患者,临床上存在着明显的未满足的医疗需求。
贝舒地尔的出现为这些患者提供了新的治疗选择。作为一种靶向ROCK2信号通路的药物,贝舒地尔能够重新平衡患者的免疫系统,减少炎症和纤维化的发生。临床试验数据表明,贝舒地尔治疗cGVHD的整体缓解率(ORR)可达75%以上,6个月无失败生存率(FFS)可达75%,2年总体生存率可达89%。这些数据充分证明了贝舒地尔在cGVHD治疗中的疗效和安全性。
此外,贝舒地尔还具有较低的副作用和较好的耐受性。常见的副作用包括恶心、呕吐、腹泻、疲劳等,但大多数患者都能够耐受并继续接受治疗。这使得贝舒地尔成为了一种值得推广和应用的cGVHD治疗药物。
贝舒地尔的市场前景
随着贝舒地尔在全球范围内的获批上市和临床应用的不断深入,其市场前景也愈发广阔。cGVHD作为一种严重的并发症,对患者的生活质量和生存期产生了极大的影响。传统的治疗方法虽然取得了一定的疗效,但仍存在着诸多不足。贝舒地尔作为一种新型的药物,以其独特的作用机制和显著的疗效,为cGVHD患者带来了新的希望。
从全球市场来看,贝舒地尔已经在美国、欧洲、加拿大等多个国家和地区获得了批准上市。随着临床应用的不断推进和患者口碑的逐渐积累,贝舒地尔的市场占有率有望进一步提升。同时,随着医药技术的不断进步和研发投入的增加,贝舒地尔还有可能拓展到其他相关领域的应用,如自身免疫性疾病等。
从国内市场来看,贝舒地尔的上市同样具有重大意义。国内是一个人口众多、医疗资源相对匮乏的国家,cGVHD患者的治疗需求十分迫切。贝舒地尔的上市不仅填补了国内cGVHD二线治疗的空白,也为患者提供了新的治疗选择。随着国家对医药产业的支持力度不断加大和医保政策的不断完善,贝舒地尔在国内市场的销售前景也十分广阔。
结论与展望
综上所述,贝舒地尔作为一种新型的靶向治疗药物,在cGVHD的治疗中展现出了显著的疗效和安全性。其全球范围内的上市时间虽然有所不同,但都已经为患者带来了新的希望和可能。随着临床应用的不断深入和市场需求的不断增加,贝舒地尔的市场前景愈发广阔。
未来,我们期待贝舒地尔能够在更多的国家和地区获得批准上市,为更多的cGVHD患者提供治疗帮助。同时,我们也期待医药界能够继续加强研发和创新,推出更多像贝舒地尔一样优秀的药物,为人类的健康事业做出更大的贡献。在这个过程中,政府、企业、医疗机构和患者等各方需要共同努力和协作,形成合力,推动医药产业的持续发展和进步。