 杨冰
杨冰 在医学教科书的边缘章节,藏着这样一群患者:他们的病症像散落的拼图,每种仅影响数百或数千人,却承载着整个家庭的重负。这些被称为“罕见遗传病”的疾病,长期被药企忽视——患者太少,研发成本太高,就像医学领域的“孤儿”。然而,随着基因编辑技术的突破性进展,这一困境正被彻底改写。从CRISPR“基因剪刀”到碱基编辑技术,科学家正用代码般的精准操作,为罕见病患者编织生命的密码。
一、罕见遗传病:沉默的“基因战争”
罕见遗传病种类超过7000种,80%由单基因突变引起。当父母双方携带隐性致病基因时,孩子可能从健康到发病仅需一个基因的“叛变”。以脊髓性肌萎缩症(SMA)为例,患儿会因运动神经元退化逐渐丧失运动能力,甚至无法吞咽呼吸;而亨廷顿舞蹈症患者则会在清醒意识下,身体不受控地扭动直至生命凋零。
数据背后的隐痛:
全球罕见病患者超3亿,国内约2000万
仅5%的罕见病有获批疗法,多数患者终身面临死亡威胁
患者平均确诊周期长达5-7年,误诊率高达40%
“传统疗法如同‘打补丁’,只能缓解症状,而基因治疗直指病因,相当于重写生命程序。”——复旦大学附属儿科医院遗传病研究所李教授
二、技术革命:基因疗法的三大“神器”
1. CRISPR-Cas9:基因剪刀的精准剪裁
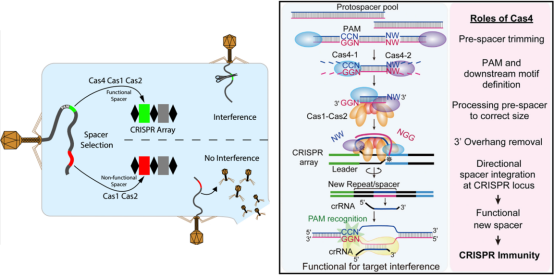
2012年问世的CRISPR技术,通过向导RNA精准定位致病基因,像剪刀一样切除突变片段。在β-地中海贫血治疗中,科学家成功将患者造血干细胞中的缺陷基因替换为正常版本,使患者摆脱终身输血的命运。
技术突破:
新型“碱基编辑”可实现单个碱基修正(如将A→G),避免DNA双链断裂风险
腺相关病毒(AAV)载体升级,可携带更大治疗基因进入细胞
2. 外显子跳跃:绕过缺陷基因的“交通管制”
针对杜氏肌营养不良症(DMD),反义寡核苷酸(ASO)药物能“指挥”细胞跳过突变外显子,恢复抗肌萎缩蛋白表达。2023年FDA批准的Viltepso,使患儿行走能力平均提升50米。
3. 基因添加:填补生命缺失的“拼图”
在莱伯氏先天性黑蒙症治疗中,科学家将正常RPE65基因装入AAV载体注入视网膜,使患者首次看清母亲的面容。这类“补缺”疗法已在血友病、遗传性失明等领域展现惊人效果。
三、生命奇迹:从实验室到临床的跨越
案例1:SMA患儿诺亚的“重生”
2020年,出生仅6个月的诺亚注射了天价基因药物Zolgensma,成为全球首个通过单次治疗逆转SMA的婴儿。如今4岁的他,已能奔跑玩耍。“这不仅是医学胜利,更是人类同理心的胜利”——诺亚父母在社交媒体上的话引发百万转发。
案例2:血友病患者的“止血希望”

罗氏开发的Hemlibra通过模拟凝血因子功能,使A型血友病患者年出血率降低99%。更振奋的是,国内企业自主研发的BBM-H901注射液已进入Ⅲ期临床,有望打破进口药垄断。
伦理争议:天价药费与生命权重
Zolgensma定价212万美元引发全球争议,背后是单次治疗需个性化制备的巨额成本。医保谈判、慈善援助、专利豁免等成为平衡医疗公平的关键砝码。
四、未来挑战:从“可治”到“治愈”的长路
1. 技术瓶颈:脱靶效应与免疫排斥
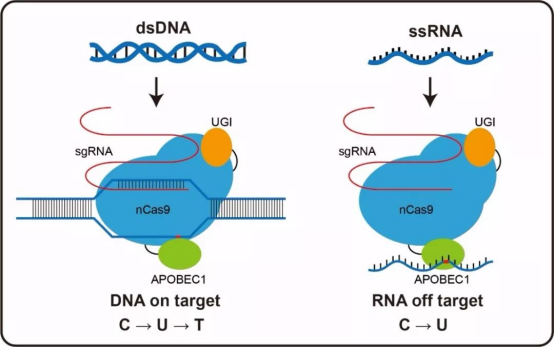
尽管CRISPR精度已达99.9%,但剩余0.1%的脱靶可能引发癌症风险。科学家正在开发“安全锁”技术,如引入自毁基因防止异常增殖。
2. 个体化治疗:从“通用型”到“量体裁衣”
随着全基因组测序成本降至千元以下,未来患者可能通过一滴血获得专属基因疗法。AI辅助设计将加速药物开发周期,从“十年磨一剑”变为“三年见曙光”。
3. 政策破冰:加速审批与人道主义使用
美国FDA的“突破性疗法”通道已让多款基因药物提前上市,国内NMPA推出的“附条件批准”制度,为罕见病患者争取到更多生存机会。
五、国内力量:从跟跑到领跑的基因长征
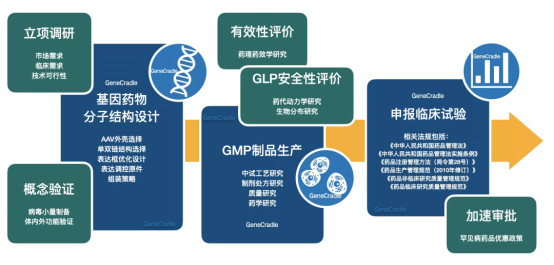
科研突破:中科院团队实现全球首例亨廷顿舞蹈症基因编辑猴模型
产业爆发:信达生物、药明巨诺等企业布局基因治疗赛道,多款国产AAV载体药物进入临床
政策扶持:2023年《罕见病用药保障条例》将70余种药物纳入医保,谈判价格平均降幅超60%
患者组织声音:
“十年前我们抱团取暖,现在终于看到隧道尽头的光”——罕见病发展中心创始人黄如方
结语:重写生命密码的“基因革命”
当科学家在纳米尺度上操作DNA时,他们不仅在与疾病作战,更在重新定义“不可能”的边界。基因疗法带来的不仅是医学突破,更是对人类尊严的捍卫。或许在不久的将来,那些曾被判“死刑”的罕见病患者,能像普通人一样奔跑、欢笑,甚至实现未曾敢想的梦想。这场由代码、伦理与希望交织的革命,终将照亮所有被遗忘的生命角落。

扫一扫联系我们
获得更详细的医药咨询

扫一扫联系我们
获得更详细的医药咨询




















